
به گزارش سرویس آموزش عمومی پایگاه خبری ساعدنیوز، معادله شیمیایی به معادله ای می گویند که به طور تقریبی، همه دانش آموزان و دانشجویان به هنگام یادگیری علم شیمی با آن ارتباط پیدا می کنند. این معادله به کمک اعداد و نمادهایی نوشته می شود که فرآیند انجام شده به هنگام یک واکنش شیمیایی را نشان می دهد. علاوه بر این، معادله شیمیایی با بکارگیری نماد های مختلف، شرایط مختلفی همچون جهت انجام واکنش یا حالت فیزیکی مواد شرکت کننده در واکنش را به ما نشان می دهد. خوب است بدانید که معادله شیمیایی برای اولین بار در سال 1615 توسط شیمیدان فرانسوی «ژان بگین» (Jaan Beguin) مورد استفاده قرار گرفت. که در فصل دوم شیمی پایه دهم با این مبحث آشنا شده خواهید شد.
جهت یک واکنش شیمیایی را به کمک معادله شیمیایی می توان مشخص کرد. به عبارت دیگر، واکنش دهنده ها و فرآورده ها به کمک یکی از 3 نماد زیر مشخص می شوند.
«→→»: واکنش یک طرفه
«⇌⇌»: واکنش تعادلی (دوطرفه) یا برگشت پذیر
«==»: برای نمایش روابط استوکیومتری
در برخی متون، برای نمایش واکنش هایی که در هر دو جهتِ رفت و برگشت انجام می شوند، از نماد «⇄⇄» بهره می گیرند.
بار دیگر نگاهی به معادله شیمیایی بالا خواهیم داشت. می بینیم که به غیر از ضرایب استوکیومتری واکنش، حروف انگلیسی نیز در داخل پرانتز وجود دارند. این حروف بیانگر حالت فیزیکی فرآورده ها یا واکنش دهنده ها در طول مدت زمان واکنش است و به طور کلی، به چهار شکل زیر نوشته می شوند:
(s): حالت جامد
(l): حالت مایع
(g): حالت گاز
(aq): ذرات در «محلول آبی» (Aqueous Solution)
برخی از واکنش های شیمیایی برای شروع نیاز به انرژی دارند. اگر انجام واکنش، به انرژی نیاز داشته باشد، در بالای فلش ها نشان داده می شود. این انرژی را به دو شکل می توان نشان داد
استفاده از نماد یونانی دلتا (Δ)(Δ) به معنای انرژی اضافه شده به شکل گرما
به کمک عبارت «hνhν»، به معنای انرژی فوتون. استفاده از این عبارت یعنی برای انجام واکنش به نور نیاز داریم.
به یاد داشته باشید که ضرایب استوکیومتری پشت هر ماده در واکنش، برای این استفاده می شود تا بیانگر قوانین پایستگی بار و جرم باشد.
در معادلات شیمیایی که الکترولیت داشته باشیم، می توان آن را به دو بخش تقسیم کرد و معادله شیمیایی را به صورت یونی نوشت. از این واکنش ها برای توصیف واکنش های جانشینی یگانه و دوگانه استفاده می شود.
در مثال زیر، یک نمونه معادله شیمیایی یونی را بررسی می کنیم. معادله اول، یک معادله شیمیایی و معادله دوم معادله ای به صورت یونی است.
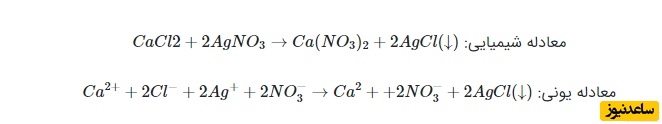
در موارد بسیار کمی، برای نشان دادن رسوب، به جای استفاده از عبارت «(s)» در کنار فرآورده، از (↓)(↓) کمک می گیرند. با مقایسه فرآورده ها و واکنش دهنده های معادله یونی و شیمیایی، مشاهده می کنیم که یون کلسیم (Ca2+)(Ca2+) و یون نیترات NO−3NO3− در هر دو طرف معادله یونی حضور دارند. به این یون ها «یون تماشاچی» (Spectator Ion) می گویند زیرا در واکنش شیمیایی، شرکت نمی کنند.
معادله یونی خالص برای مثال بالا را بعد از حذف یون های تماشاچی، می توان به شکل زیر نوشت. در حقیقت، در اینجا، معادله را تنها برای یون های شرکت کننده در واکنش نوشتیم:
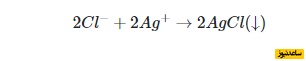
معادله یونی بالا را این گونه می توان توصیف کرد که دو یون کلرید – ناشی از کلسیم کلرید – با دو کاتیون نقره – ناشی از نقره نیترات – وارد واکنش می شوند تا رسوب نقره کلرید به تولید برسد.
زمانیکه یک شیمیدان، با واکنشی جدید مواجه می شود، به طور معمول معادله آن در حالت موازنه شده خود وجود ندارد. در عوض، شیمیدان باید واکنش دهنده ها و فرآورده ها را مشخص کند و سپس آن ها را به شکل یک معادله شیمیایی بنویسد و آن را موازنه کند. به طور مثال، سوختن نرمال هپتان با فرمول شیمیایی C7H16C7H16 را در نظر بگیرید.
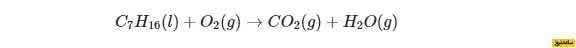
در اثر سوختن کامل هر نوع هیدروکربن با مقدار کافی از اکسیژن، دی اکسید کربن و آب تولید می شود. واکنش بالا موازنه نیست. تعداد اتم های کربن، اکسیژن و هیدروژن در طرف چپ معادله، با تعداد آن ها در طرف راست معادله، برابر نیستند. بنابراین، مقدار ضرایب پشت واکنش دهنده ها و فرآورده ها باید به گونه ای تنظیم شوند تا اتم ها در هر دو طرف، مقدار یکسانی داشته باشند.
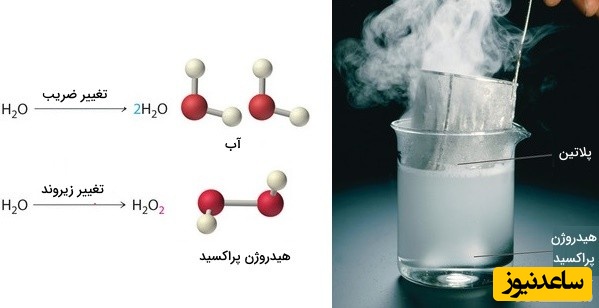
توجه داشته باشید که در این شرایط، تنها می توانیم ضرایب پشت مولکول ها را تغییر دهیم زیرا با تغییر زیروندها، نوع ماده واکنش دهنده یا فرآورده به طور کامل عوض می شود. به طور مثال، در تصویر زیر، اگر ضرایب پشت مولکول تغییر پیدا کنند، نوع مولکول (در اینجا آب) تغییری پیدا نمی کند اما با تغییر زیروندها، مولکول آب به یک مولکول دیگر (هیدروژن پراکسید) تبدیل خواهد شد.
عمومی ترین و ساده ترین روش برای موازنه یک واکنش شیمیایی، «روش وارسی» (Inspection Method) یا آزمون و خطا نام دارد. در ادامه، نحوه موازنه واکنش شیمیایی به روش وارسی را بیان می کنیم. این روش موازنه، شامل چهار مرحله کلی است.
کار را با پیچیده ترین ترکیب شروع و فرض کنید تنها یک مولکول از این ترکیب در واکنش شرکت می کند.
اتم با کمترین تعداد در این ترکیب را در دو طرف موازنه کنید. برای این کار، می توان از ضرایب کسری نیز کمک گرفت.
در انتها، تعداد اتم های مشترک در سایر ترکیبات را موازنه کنید.
بعد از این که اتم ها و بارهای الکتریکی، موازنه شدند، با اعمال ضرایب مناسب، عبارات کسری را حذف کنید.

اگر در معادله واکنش، ذرات باردار داشته باشیم، این بارها را نیز باید موازنه کنیم. به طور مثال، واکنش زیر را در نظر بگیرید:
Fe2++PO3−4→Fe3(PO4)2Fe2++PO43−→Fe3(PO4)2
موازنه این معادله شیمیایی قدری ساده است. پیچیده ترین مولکول، آهن (II) فسفات در سمت راست معادله است. با فرض این که یک مولکول از این ترکیب پیچیده داشته باشیم، باید ضریب 3 را برای Fe2+Fe2+ و ضریب 2 را برای یون فسفات در نظر بگیریم. با این کار، معادله شیمیایی ما موازنه می شود.
3Fe2++2PO3−4→Fe3(PO4)23Fe2++2PO43−→Fe3(PO4)2
حال، به سادگی می توانیم موازنه بار را نیز بررسی کنیم. مقدار بار در سمت راست، برابر با صفر است. در سمت چپ نیز این میزان طبق محاسبات زیر، برابر با صفر خواهد بود که نشان می دهد، معادله، موازنه شده است.
3×(+2)+2×(−3)=6−6=03×(+2)+2×(−3)=6−6=0

البته موازنه معادله شیمیایی به روش وارسی، با محدودیت هایی نیز همراه است. به طور مثال، واکنش زیر را در نظر بگیرید:
CH3ONa+NaClO2+HCl→COCl2+NaCl+H2OCH3ONa+NaClO2+HCl→COCl2+NaCl+H2O
اگر بخواهیم واکنش بالا را به روش وارسی، موازنه کنیم به جایی نمی رسیم. به کمک دو قانون اول، موازنه را از کربن آغاز خواهیم کرد و ضریب 1 را برای CH3ONaCH3ONa در نظر می گیریم. با این کار، نتیجه می گیریم که 1 مولکول از COCl2COCl2 نیز به تولید می رسد. این ساده ترین بخش کار بود.
سایر اتم ها در ترکیبات دیگر یافت می شوند. بنابراین، زمانیکه ضریبی را در پشت یک مولکول قرار دهیم، حداقل، تعداد دو اتم دیگر تغییر می کنند. در نتیجه، باید از سایر روش ها برای موازنه استفاده کنیم.