فصل اول شیمی دهم که کیهان زادگاه هستی نام دارد یکی از فصل های مهم شیمی دوره دوم متوسطه می باشد. نکاتی دارد که در متن کتاب یافتن آن ها سخت است. جزوه شیمی دهم فصل اول اینجاست که اهمیت زیادی پیدا می کند. جمع آوری نکات فصل اول و تفهیم کامل فصل اول شیمی دهم از ویژگی های این جزوه می باشد. بخش اول جزوه کامل شیمی دهم را باید در اینجا دانلود کنید. با دانلود جزوه شیمی دهم فصل اول خودتون رو از جزوه شیمی دهم فصل اول دیگری بی نیاز کنید و بر فصل اول شیمی دهم به صورت کامل مسلط شوید. این جزوه شیمی دهم تجربی و ریاضی می باشد و نیاز دانش آموزان هر دو رشته را براآورده می کند.
اعداد کوانتومی
شرودینگر با حل معادلاتش سه عدد را جهت توصیف الکترون های یک اتم ارائه داد. این اعداد عبارتند از:
- n: عدد کوانتومی اصلی
- L: عدد کوانتومی فرعی یا اوربیتالی
- m: عدد کوانتومی مغناطیسی
- s: عدد کوانتومی مغناطیسی اسپینی
عدد کوانتومی اصلی یا n، نشان دهنده اندازه و انرژی اوربیتال است. منظور از اندازه اوربیتال، فاصله الکترون ها از هسته اتم است. هر چه اندازه این عدد بیشتر باشد، اندازه و انرژی اوربیتال نیز بزرگ تر خواهد بود. تمامی الکترون هایی که n آن ها با هم برابر است، در فاصله ای یکسان از هسته اتم قرار می گیرند.
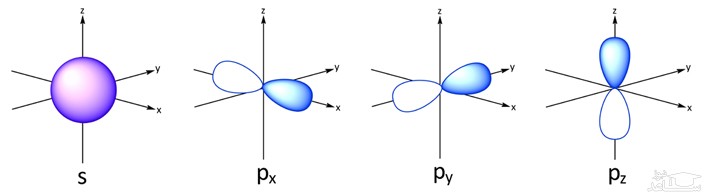
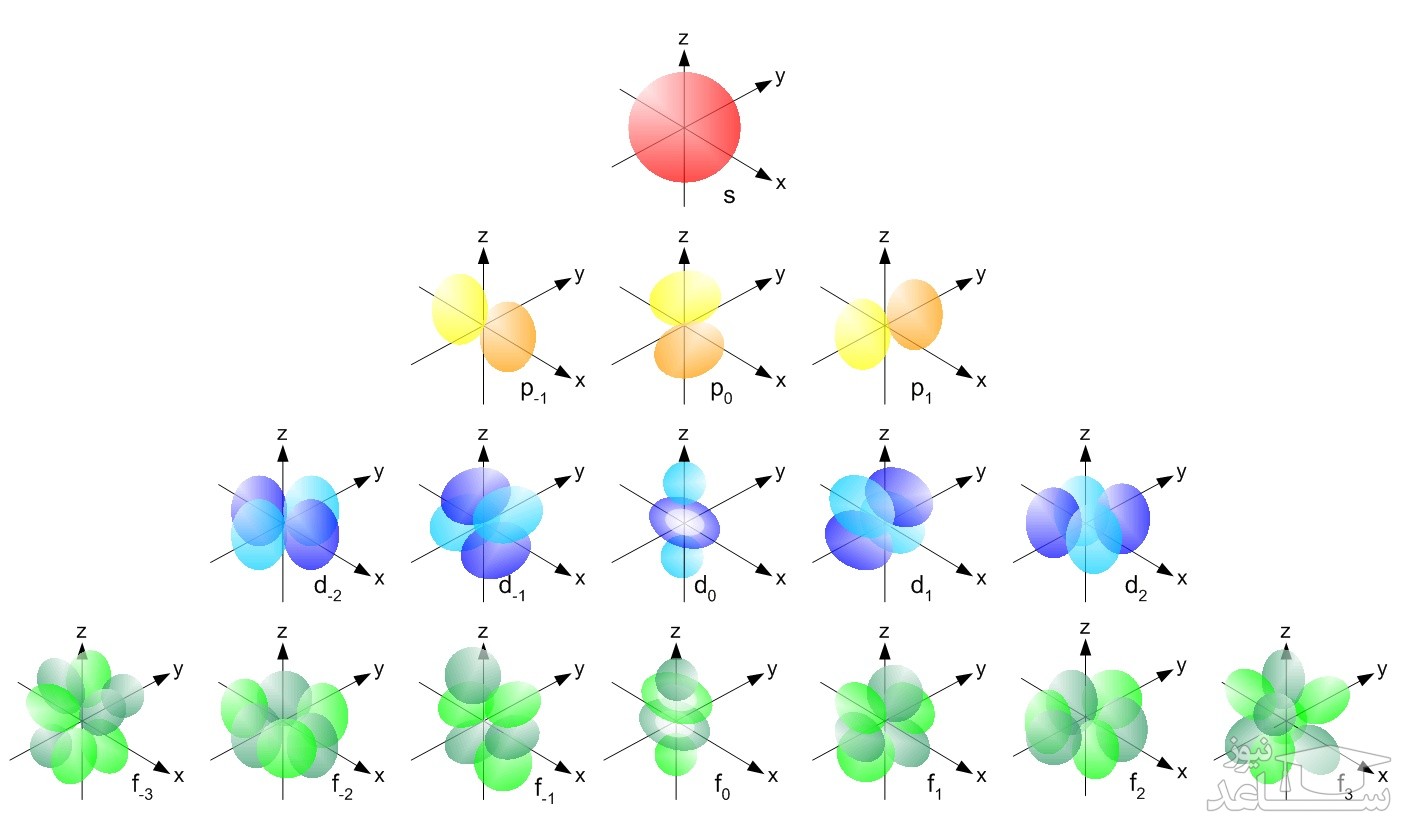
L یا عدد کوانتومی فرعی، نشان دهنده شکل اوربیتال است. یک لایه با عدد کوانتومی n می تواند از n-1 اوربیتال مختلف تشکیل شده باشد. شکل های یک اوربیتال را با نماد های s,p,d,f,…s,p,d,f,… نشان می دهند. برای نمونه L=۰ نشان دهنده اوربیتال s یا L=۱ اوربیتال p را نشان می دهد. تصویر ارائه شده، شکل اوربیتال های مختلف را نمایش می دهد.

با توجه به شکل فوق، اوربیتال s کروی بوده و تنها به یک صورت می تواند در فضا قرار گیرد. اما مثلا اوربیتال p می تواند هم در راستای محور z و هم در راستای محور x جهت گیری کند. از این رو به عدد سومی تحت عنوان m یا عدد کوانتومی مغناطیسی نیازمندیم تا این جهت گیری اوربیتال ها را نشان دهیم. بنابراین عدد m جهت گیری اوربیتال را در فضا نشان می دهد. عدد کوانتومی مغناطیسیِ یک اوربیتال، بین L- و L+ قرار دارد. برای نمونه اعداد کوانتومی مغناطیسی برای اوربیتال p که L مربوط با آن ۱ است، برابر با 1+,1,0- در نظر گرفته می شوند.
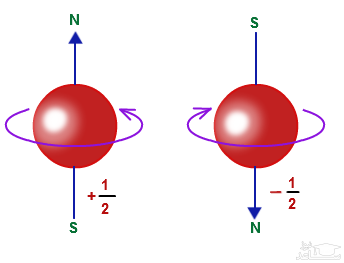
اگر الکترون را به صورت یک کره در نظر بگیریم، با استفاده از ۳ عدد معرفی شده در بالا می تواند جهت حرکت آن را در فضا مشخص کرد. اما این الکترون، به دور خودش نیز در حال چرخش است. این چرخش را با عدد کوانتومی اسپینی یا ms نشان می دهند. بنابراین یک الکترون می تواند تنها ساعتگرد (s=-1/2) و یا پادساعتگرد (s=+1/2) چرخش کند. در شکل زیر چرخش الکترون در این دو حالت نشان داده شده است.
اوربیتال ها و الکترون ها
همان طور که بیان شد هر اوربیتال دارای شکل مشخصی است که با توجه به اعداد کوانتومی معلوم می شوند. در ادامه اعداد کوانتومی مرتبط با هر اوبیتال و نحوه قرار گرفتن الکترون ها در اوربیتال ها را بیان خواهیم کرد.
شکل اوربیتال
در هر لایه یا به عبارتی در هر n، تعداد n-1 اوربیتال متفاوت می تواند قرار گیرد. برای نمونه در لایه اول تنها اوربیتال l=0 یا همان اوربیتال کروی وجود دارد. در n=2 دو اوربیتالِ کرویِ (l=0) و دمبلی (l=1) می توانند قرار گیرند. از طرفی اوربیتال کروی تنها به یک شکل می تواند در فضا قرار گیرد، از این رو m آن تنها برابر با ۰ می تواند باشد. این در حالی است که اوربیتال دمبلی به ۳ شکل می تواند در فضا قرار گیرد، در نتیجه m=-1,0,+1 است. شکل زیر دو اوربیتال s و p را نشان می دهد.
به همین صورت اعداد هر اوربیتال معلوم می شوند. برای نمونه اوربیتال p (یا همان دمبلی) را در نظر بگیرید که در لایه سوم قرار گرفته است. برای این اوربیتال اعداد کوانتومی به صورت زیر هستند.
- n=3
- m=-1,0,+1
- L=1
توجه داشته باشید که عدد کوانتومی اسپینی برای یک الکترون تعریف می شود، به همین دلیل این عدد در بالا ارائه نشده. اوربیتال های با l=1 (اوربیتال p) به بالا دارای شکل هایی بسیار پیچیده هستند که به صورت گوناگونی می توانند در فضا قرار گیرند. در جدول زیر ترتیب لایه ها و زیرلایه ها (اوربیتال ها) برای چهار لایه اول ارائه شده است.
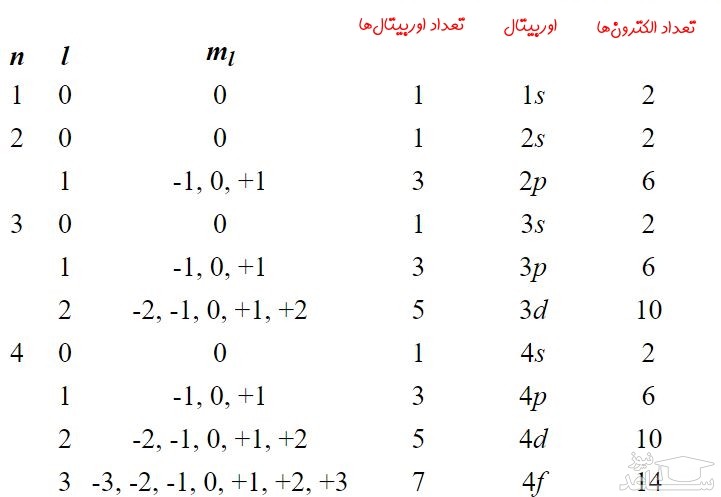
در جدول بالا ستونی تحت عنوان تعداد الکترون ها وجود دارد. این ستون ظرفیت تعداد الکترون های قرار گرفته در هر اوربیتال را نشان می دهد. برای نمونه اوربیتال p در سه جهت می تواند در فضا قرار گیرد. از طرفی در هرکدام از این حالات ۲ الکترون می تواند در اوربیتال مذکور وجود داشته باشد؛ بنابراین ظرفیت این اوربیتال برابر با ۶=۳×۲ است. البته ظرفیت هر اوربیتال با عدد L را می توان با استفاده از فرمولِ 2(2L+1)2(2L+1) نیز بدست آورد.
در تصویر زیر، شکل اوربیتال های s,p,d,f نشان داده شده.
ترتیب قرار گرفتن الکترون ها در اوربیتال ها
الکترون های یک اتم با نظم مشخصی در اوربیتال ها قرار می گیرند. در ابتدا لایه های با انرژی کم تر توسط الکترون ها پر شده و پس از آن لایه های دورتر توسط آن ها اشغال می شوند. با استفاده از «اصل آفبا» (Aufbau Principle) می توان ترتیب الکترون ها را در پر کردن اوربیتال ها معلوم کرد.
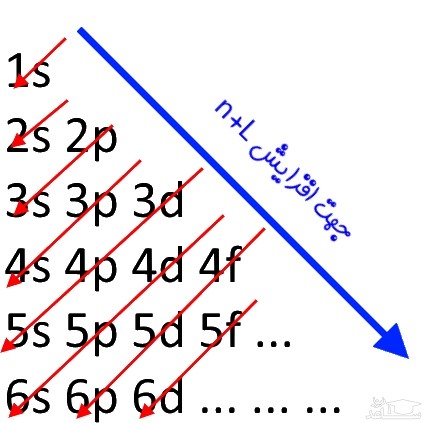
در این اصل در ابتدا لایه با n کمتر توسط الکترون ها اشغال می شوند. هم چنین در یک لایه، ابتدا اوربیتال با انرژی کمتر پر می شود. برای نمونه در لایه دوم هر دو اوربیتالِ p و s وجود دارند. اما با توجه به انرژی کم تر اوربیتال s، در ابتدا این اوربیتال پر می شود. اما گاهی اوربیتال p در لایه ای پایین تر به نسبت اوربیتال s قرار دارد. به نظر شما در این حالت اولویت با شماره لایه یا شکل اوربیتال است؟ در این حالت لایه ای زود تر پر می شود که:
- n+L برای آن کمتر باشد.
- اگر n+L برابر باشد، n کمتر، زودتر پر می شود.
بر اساس دو الگوی بالا، الکترون ها به ترتیب در اوربیتال های زیر قرار می گیرند:
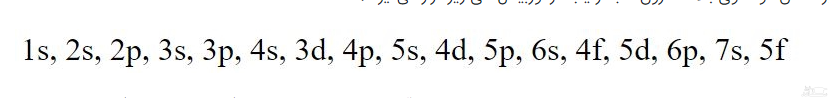
همان طور که در فرمول بالا می بینید در ابتدا شماره لایه و پس از آن حرف مربوط به زیرلایه (یا همان اوربیتال) نوشته می شود. البته به منظور به خاطر سپردنِ عبارت فوق می توانید از تصویر زیر نیز استفاده کنید.
رسم آرایش الکترونی
همان طور که در بالا نیز بیان شد، هر اوربیتال می تواند 2(2L+1)2(2L+1) الکترون را در خود نگه دارد. برای نوشتن آرایش الکترونی یک اتم می توان به ترتیب پر شدن، اوربیتال ها را نوشت. در بالای هر اوربیتال ظرفیت مربوط به آن نوشته می شود. در ادامه آرایش الکترونی چندین اتم برای نمونه ارائه شده اند. البته بعضی مواقع اوربیتال ها را به صورت مربع نشان می دهند. هم چنین الکترون ها را با فلش هایی نمایش می دهند که جهت آن، اسپین الکترون را نشان می دهد. جهت درک بهتر به مثال های زیر توجه فرمایید. نماد های استفاده شده در نوشتن آرایش الکترونی مطابق با الگوی زیر تعریف می شوند.
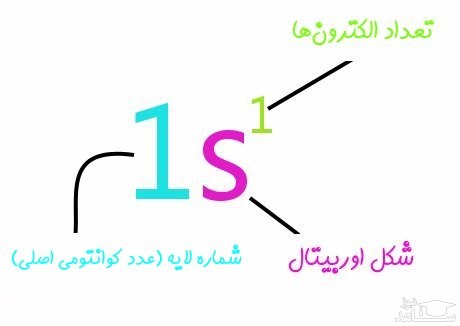
مثال ۱
آرایش الکترونی اتم لیتیوم به چه صورت است؟
همان طور که احتمالا می دانید عدد اتمی لیتیوم، ۳ در نتیجه مجموع الکترون های اشغال شده در اوربیتال هایش نیز برابر با ۳ است؛ مطابق با اصل آفبا، آرایش الکترونی اتم لیتیوم به صورت زیر خواهد بود.
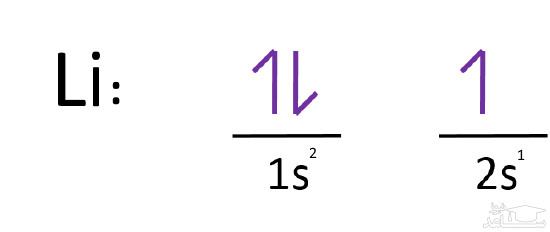
همان طور که می بینید در لایه اول اوربیتال s پر شده، اما در لایه دوم تنها یک الکترون در اوربیتال s قرار گرفته است. توجه داشته باشید که جهت بالا و پایین، جهت چرخش الکترون دور خودش -یا همان اسپین- را نشان می دهد.
مثال ۲
آرایش الکترونی اتم کربن به چه شکل است؟
عدد اتمی کربن برابر با ۶ است. در نتیجه مجموع الکترون های موجود در اوربیتال ها بایستی برابر با ۶ باشد. توجه داشته باشید که در ابتدا یک اوربیتال بایستی پر شده و سپس اوربیتال بعدی را پر کنید. در زیر آرایش الکترونی اتم کربن رسم شده.
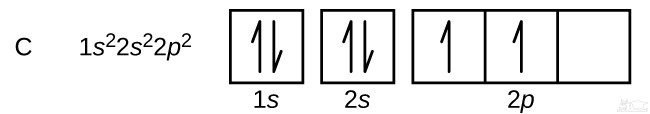
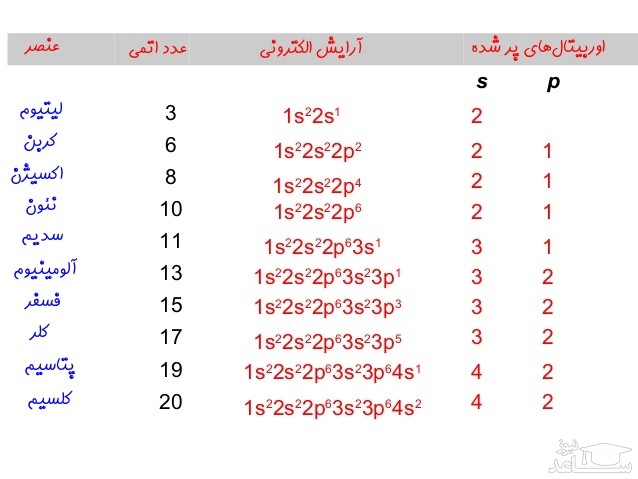
در آرایش بالا هر خانه نشان دهنده یک جهت از اوربیتال است. با توجه به این که اوربیتال p به ۳ شکل در فضا قرار می گیرد، بنابراین از سه خانه برای نشان دادن آن استفاده شده است. به منظور رسم فلش ها، از چپ به راست در هر خانه یک فلش رو به بالا قرار داده و به همین شکل اوربیتال را پر کنید. مجموعِ کل فلش ها بایستی برابر با عدد اتمی اتمِ مذکور باشد. پیشنهاد می کنیم چندین آرایش الکترونی را برای اتم های مختلف نوشته و صحت آن با توجه به جدول زیر مورد بررسی قرار دهید.
البته با توجه به پایدار بودن عناصر نجیب، می توان با استفاده از آن ها نیز آرایش الکترونی را بیان کرد. برای نمونه در زیر آرایش الکترونی اتم کربن بر اساس آرایش هلیوم ارائه شده است.
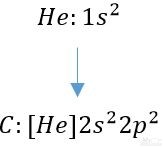
توجه داشته باشید که به منظور نوشتن آرایش الکترونی یون ها، عدد اتمی برابر با تعداد الکترون ها نیست. برای نمونه در زیر آرایش الکترونی اتم آهن (Fe) و در نتیجه یونِ آهن (2+Fe) ارائه شده است.
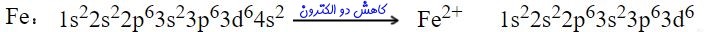



 آموزش فصل دوم شیمی دهم به همراه نمونه سوال
آموزش فصل دوم شیمی دهم به همراه نمونه سوال